【コラム/5月3日】福島事故の真相探索 第4話
ジルカロイ・水反応の発熱量
いよいよ本命の、ジルカロイ・水反応の話となる。
第3話での検討から、反応に関与したジルカロイ量は16トンであった。ジルコニウムの化学反応等量1モルは91gである。ジルカロイ・水反応の方程式は、 Zr+2H₂O=ZrO₂+2H₂ であるから、16トンのジルコニウムが反応したとすれば、反応に使われた水量は約6.3トン、発生した水素ガス量は約0.7トンとなる。
中学生が習うようなことを書いたのは、ジルカロイ・水反応はあまり知られていないので、以降の説明についての量的な目安を持ってもらうための、余計な無駄書きである。
次に、ジルカロイとその酸化膜(二酸化ジルコニウム)についての性質について述べる。
ジルカロイはジルコニウムを主体とした合金である。温度が低いときは極めて安定した合金であるが、温度が約800℃を越えると水と反応して表面に酸化膜ができる。銀色であったジルカロイ被覆管の表面は真っ黒に変色する。これがジルカロイ・水反応の始まりである。
反応自体は、一般金属の酸化反応と変わるところはない。だがジルカロイの場合、反応にも、酸化膜にも大きな特徴をもつ。
その一番手が、反応熱の大きさだ。ジルカロイ・水反応の発熱量はべらぼうに大きく、ジルコニウム1モル(約91g)当りの発熱は、586kJもある。目安話しをすれば、燃料棒の被覆管が全て反応すれば、その発熱量は、中のUO2ペレット(融点2880℃)を完全に溶かす程大きい。この大きな反応熱が、ペデスタル壁に空洞を作った発熱である。
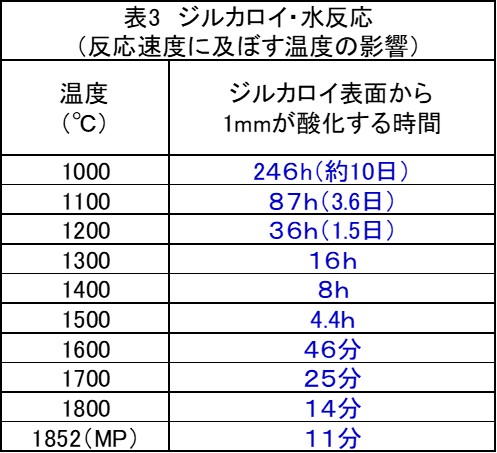
ジルカロイの酸化膜も特徴が多い。その第一は、酸化皮膜が非常に緻密であることで、燃料棒表面に出来た酸化膜は、管の表面を流れる水や水蒸気の侵入をほとんど許さない。しかし、温度が1500℃以上になると、酸化膜を通して酸素の拡散侵入速度は増加し、その結果として酸化速度も上昇する。
さらに温度が1800℃近くになると、反応熱がジルカロイ温度を上昇させ、温度上昇が酸化速度を速めるといった、正の温度上昇状態――と言うより悪循環――がジルカロイに生じる。こうなると、酸化反応はジルカロイが燃え尽きるまで継続し、巨大な発熱が短時間に生じる。この発熱を「爆発的なジルコニウム燃焼」と呼ぶ人もいる。これがジルカロイ・水反応の発熱の特徴である。
ついでながら、軽水炉の最悪事故と言われる大口径破断冷却材喪失事故の規制基準は、この悪循環防止のための制限条件として、被覆管表面温度を1200℃以下に保つよう規定している。この点については第5話で述べる。
参考のために、表にジルコニウム温度と酸化速度の関係を示す。